Как перелом влияет на мочу

 В ответ на повреждение кости возникают не только местные изменения, но и выраженные общие изменения. Нарушается гомеостаз.
В ответ на повреждение кости возникают не только местные изменения, но и выраженные общие изменения. Нарушается гомеостаз.
Общая реакция организма на повреждение кости получила название синдрома перелома. В синдроме перелома можно выделить две фазы (стадии).
В первой стадии, катаболической, процессы распада доминируют над анаболическими изменениями. Организм как бы создает условия для будущего процесса созидания.
Катаболические реакции, не ограничиваясь местом повреждения, протекают во всех органах и системах, чем и обеспечивается перераспределение пластических и энергетических ресурсов организма.
Во второй, анаболической стадии катаболические процессы затухают и доминируют реакции синтеза. Это приводит к обновлению тканей не только в области перелома, но и на расстоянии от него в других органах и системах.
Интенсивность и продолжительность катаболических и анаболических процессов обусловлена тяжестью повреждений, реактивностью организма, возрастом больных и т. д. Так, у лиц старческого возраста катаболические изменения протекают менее бурно и более продолжительно, чем у молодых.
В сложном механизме нейрогуморальной регуляции метаболизма важную роль играет щитовидная железа, гормоны которой стимулируют диссимиляторно- окислительную фазу обмена. Уже в первые часы после травмы функция щитовидной железы снижается под влиянием уменьшения секреции тиреотропного гормона в гипофизе и резкого усиления выброса в кровь кортизона и АКТГ. О снижении функции щитовидной железы свидетельствует уменьшение концентрации в крови белковосодержащего йода, снижение поглощения щитовидной железой радиоактивного йода и увеличение его выделения с мочой.
Уменьшение образования тироксина щитовидной железой компенсируется его активацией на периферии и избыточным содержанием гормонов надпочечников, что обусловливает усиление катаболических процессов.
Травма приводит к угнетению секреции гонадотропных гормонов и подавлению инсулярного аппарата поджелудочное железы. В этот период определяется резистентная гипергликемия. Парентеральное введение инсулина не приводит к снижению сахара в крови.
Для синдрома перелома костей характерно изменение белкового обмена.
О резкой активности протеолиза в катаболическую фазу можно судить по высокому выведению азота с мочой. Азотурия при переломах значительно выше, чем при повреждениях мягких тканей. Суточная потеря азота при травме костей может достигать 25—30 г. Отрицательный баланс азота сохраняется в течение 2—3 нед. Спустя 3 нед баланс азота становится положительным, что свидетельствует о преобладании синтеза протеинов.
Смена отрицательного баланса азота, положительным служит критерием перехода от каталитической к анаболической фазе синдрома перелома. Контроль за выведением азота позволяет уловить этот переход.
Для синдрома перелома костей характерна гипопротеинемия и гипоальбуминемия. Содержание альбуминов в крови снижается как в первые дни после травмы, так и к моменту образования костной мозоли.
Состояние белкового обмена в организме чрезвычайно важно для репаративной регенерации кости, так как процесс образования регенерата зависит от темпов восстановления полноценного белкового синтеза. Поэтому необходимо восполнять имеющийся в организме дефицит белков и их компонентов — аминокислот. Особенно резко повышается потребность в ациклических содержащих серу аминокислотах — цистине и метионине. Поэтому во вторую фазу синдрома перелома целесообразна диета с повышенным содержанием белка (до 190 г в сутки), включающая метионин (не менее 5 г в сутки) и цистин (3 г в сутки).
Параллельно с нарушением белкового обмена происходит изменение метаболизма других веществ. В катаболическую фазу в крови в 2 раза увеличивается концентрация липидов, резко повышается активность липазы и содержание жирных кислот. Нарушается обмен углеводов, витаминов, гликопротеидов и активность ферментов.
Для начальных изменений при переломе характерна выраженная в той или иной степени деминерализация, рарефикация костей не только в области перелома и на симметрично расположенных участках, но и в других костях. В этот процесс вовлекаются в первую очередь соединения кальция. Общее количество кальция в сыворотке крови увеличивается в катаболическую фазу, т. е. в первые 2—3 нед. В анаболическую фазу имеется разница содержания кальция в венозной крови сломанной и здоровой конечности.
Биологическим критерием консолидирующего перелома является большее содержание ионов кальция в крови, оттекающей от места перелома, чем в венозной крови здоровой конечности. Этот признак предшествует рентгенологическому выявлению костной мозоли.
Содержание фосфора в крови при открытых и множественных повреждениях костей значительно увеличивается в катаболическую фазу. Затем наблюдается быстрое снижение его концентрации в крови и увеличение в тканях.
Для синдрома перелома характерно заметное отклонение от нормы содержания в сыворотке крови некоторых микроэлементов. Особенно характерно для катаболической фазы резкое увеличение меди в сыворотке крови. Содержание кремния и железа наоборот, понижается. Количество алюминия в крови несколько снижается в первые дни катаболической фазы, а затем увеличивается. С наступлением анаболической фазы содержание алюминия начинает резко падать и уже через месяц после перелома становится вдвое ниже нормы, что обусловлено его утилизацией тканями регенерата.
При обширных повреждениях кости в значительной степени нарушается свертывающая система крови, что может привести к нарушению функции жизненно важньк органов, к замедлению репаративной регенерации за счет микроэмболий сосудов регенерата в области перелома.
Разрушение белка при переломе кости приводит к развитию аутоиммунных процессов. Образованные комплексы антиген — антитело, адсорбируясь на поверхности клеток, изменяют их метаболизм и пролиферацию, что может повлиять на репарати-вную регенерацию кости.
Травматология и ортопедия. Юмашев Г.С., 1983г.
Источник
Статья посвящена проблеме нейрогенных расстройств мочеиспускания при травме позвоночника и спинного мозга
Путь пациента с осложненной травмой позвоночника, т. е. сопровождающейся повреждением спинного мозга, начинается с нейрохирургического оперативного вмешательства и продолжается многоэтапной реабилитацией, направленной на коррекцию сопутствующих осложнений и восстановление утраченных функций организма [1]. Для таких больных есть специфический термин – «спинальные».
Одним из тяжелейших последствий травмы спинного мозга является расстройство произвольного мочеиспускания, обусловленное нарушением проводимости спинномозговых путей. По данным М.Р. Касаткина, подобное осложнение встречается в 92,1% случаев закрытых повреждений спинного мозга [2]. Патогенез изменений функции нижних мочевых путей при травме спинного мозга, проявляющийся в утрате рефлекторной деятельности, сложен и многообразен [3].
Механизм нормального мочеиспускания и характер его расстройства у спинальных пациентов напрямую связаны с особенностями физиологии этой области. Периферическую иннервацию нижних мочевых путей осуществляют тазовый нерв, представляющий парасимпатическую нервную систему, гипогастральный нерв, реализующий симпатическую регуляцию, и пудендальный соматический нерв. Афферентную информацию несут волокна всех трех нервов – вегетативных от детрузора (гладкой мышцы мочевого пузыря) и уретры и полового нерва от тканей промежности. Первичным анализатором для парасимпатического тазового нерва являются нейроны сакрального центра мочеиспускания, расположенного на уровне S2‒S4 сегментов спинного мозга. Здесь же, в анатомическом соседстве, находится ядро Онуфа, представляющее собой скопление нервных клеток, аксоны которых образуют пудендальный нерв [4]. Симпатическая афферентная иннервация, опосредованная гипогастральным нервом, являющимся частью подчревного и поясничного сплетения, осуществляется через пограничный симпатический ствол и вставочные интернейроны боковых рогов спинного мозга на уровне его Th10‒L2 сегментов. Эти же нервы несут и эфферентные сигналы к иннервируемым органам. Регулирующие структуры спинного мозга связаны с вышерасположенными центрами иннервации проекционно, а также с помощью нейрогуморальных и рефлекторных механизмов [5]. Однако следует отметить, что концепции регуляции функции нижних мочевых путей в норме и патологии являются в большей степени эмпирическими, и единого понимания этого вопроса на сегодняшний день нет.
Клиническая картина
Врачу-неврологу, курирующему пациента с осложненной травмой позвоночника, необходимо оценить уровень и степень повреждения спинного мозга и учесть посттравматические сроки. Клиническая картина в острый и ранний периоды после получения травмы обусловлена спинальным шоком, что проявляется арефлексией и задержкой мочи. По мере восстановления можно наблюдать активизацию рефлекторной деятельности и формирование «в сухом остатке» нейрогенного расстройства мочеиспускания. При повреждении спинного мозга на уровне сакрального центра мочеиспускания и периферических нервных волокон развивается атония или гипотония детрузора, при этом за счет интактности симпатических структур иннервации внутренний уретральный сфинктер сохраняет сократительную способность. Таким образом, нарушается взаимосвязь симпатических и парасимпатических влияний [6]. Клинически наблюдается нейрогенная задержка мочеиспускания с элементами парадоксальной ишурии (выделения мочи по каплям на фоне переполненного мочевого пузыря). При локализации травмы выше сакрального центра и ядра Онуфа повреждаются проводниковые нервные волокна, осуществляющие взаимосвязь регулирующих структур, однако сами центры иннервации могут быть интактны. В этом случае и детрузор, и внутренний сфинктер уретры способны к циклическому сокращению и расслаблению, но рассогласованность в работе приводит не к нормальному акту мочеиспускания, а к детрузорно-сфинктерной диссинергии. Поражение на уровне нижнегрудного и верхнепоясничного отделов позвоночника, вовлекающее симпатические регулирующие структуры, вызывает нарушение сократительной способности внутреннего сфинктера уретры и недержание мочи. Травма спинного мозга на уровне шейного и верхнегрудного отделов позвоночника ведет к прерыванию взаимосвязи спинальных и стволовых, а также кортикальных структур регуляции. В ситуации, когда центры иннервации спинного мозга и нервные проводники между ними сохраняют свою анатомическую целостность, клинически может сформироваться автономный процесс мочеиспускания, а также гиперактивность мочевого пузыря. В этом случае накопление и выделение мочи происходят рефлекторно, в т. ч. с участием аксон-рефлексов, без контроля центров, отвечающих за произвольную составляющую физиологического процесса [7].
Описанные клинические нарушения достаточно вариабельны и зависят от характера и тяжести повреждения, а также сроков, прошедших с момента травмы, поэтому можно наблюдать переход одной формы нейрогенного расстройства мочеиспускания в другую.
Невролог, понимая обусловленность клинической картины уровнем поражения спинного мозга, определяет тактику ведения спинального пациента и дальнейший прогноз. Осуществление адекватной коррекции урологических осложнений лежит, несомненно, в междисциплинарной плоскости. В связи с этим нейроурологическая практика, а вернее, четкое и скоординированное взаимодействие невролога и уролога способно обеспечить квалифицированную и своевременную помощь. И если врач-невролог сосредоточен на повреждении спинного мозга и нарушении иннервации, то уролог контролирует непосредственное функциональное состояние нижних мочевых путей и коррекцию сопутствующих воспалительных и нефротических осложнений. Отсюда вытекает необходимость тесной взаимосвязи специалистов для полноценной коррекции нейрогенных расстройств мочеиспускания.
В представлении уролога, оказывающего специализированную помощь пациентам с неврологическими расстройствами, процесс мочеиспускания выглядит несколько сложнее, чем простой циклический акт, состоящий из чередования фаз накопления и выведения мочи, обеспеченный двумя основными функциями мочевого пузыря: резервуарной и эвакуаторной. Функционально этот процесс определяется синергией детрузора с гладкомышечным сфинктером уретры и мышцами тазового дна, включающими наружный уретральный сфинктер.
Физиологически мочевой пузырь, природой созданный резервуар для сбора мочи, обладает способностью к полному опорожнению в подходящее время и в удобном для совершения акта мочеиспускания месте согласно социально-поведенческим нормам. Эта крайне важная способность реализуется в результате сложной регуляции с участием центральной и периферической нервных систем. Фундаментально акт мочеиспускания – это спинальный рефлекс, обеспечиваемый работой центров головного мозга, реализация и подавление этого рефлекса находятся под волевым контролем. Возможность произвольного управления делает функцию нижних мочевых путей уникальной по сравнению, например, с сердечно-сосудистой системой, и в то же время более уязвимой при неврологических заболеваниях [8]. Таким образом, основными функциями нижних мочевых путей являются накопление мочи в мочевом пузыре, длящееся относительно продолжительное время, и мочеиспускание, занимающее в норме несколько секунд. Реципрокные отношения – расслабление/напряжение детрузора, закрытие уретрального сфинктера и сокращение/расслабление детрузора, открытие уретрального сфинктера – обеспечивают скоординированность процессов накопления и удаления мочи и находятся под нейромедиаторным контролем [9].
Нейрогенная дисфункция нижних мочевых путей является следствием патологии центральной нервной системы или периферических нервных окончаний ‒ отделов нервной системы, выполняющих контроль над актом мочеиспускания. В этом состоит главное отличие рассматриваемого нарушения от нарушений нижних мочевых путей ненейрогенной этиологии, развивающихся вследствие поражения непосредственно мочеполовой системы.
В урологическом сообществе длительное время основной опорой для определения формы нейрогенного расстройства мочеиспускания являлась классификация, предложенная профессором Г. Мадерсбахером в 1980 г. и рекомендуемая Европейской ассоциацией урологов (рис. 1) [10]. В ней автор выделяет 8 основных форм нейрогенных расстройств мочеиспускания в зависимости от состояния детрузора и внутреннего сфинктера уретры. Подразумевается, что указанные структуры могут быть в гипертонусе, гипотонусе и в нормальном состоянии. Однако сложность в постановке диагноза и категоричность в выборе одной из 8 форм нарушений мочеиспускания сегодня заставляют говорить о пересмотре форм расстройств мочеиспускания. С клинической точки зрения все возможные виды нарушений мочеиспускания рассмотреть в рамках одной из существующих классификаций невозможно. В определении поражения у пациента наиболее часто специалисты основываются на преобладающем нарушении эвакуаторной или резервуарной функции мочевого пузыря, различных видах детрузорно-сфинктерной диссинергии и уродинамических показателях максимального детрузорного давления в точке утечки. При этом важность знания о максимальном детрузорном давлении и максимальном давлении в точке утечки делает необходимым проведение специализированного уродинамического исследования практически каждому пациенту с нарушениями мочеиспускания на фоне неврологического заболевания.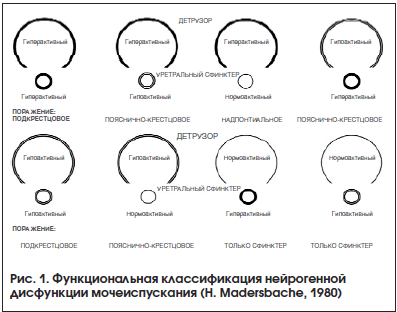
Лечение
Основными задачами урологической помощи на всех этапах нейрореабилитации являются:
1) сохранение и обеспечение функции верхних мочевыводящих путей;
2) независимость регуляции функции нижних мочевыводящих путей;
3) улучшение качества жизни.
С практической точки зрения важны борьба с вторичными осложнениями нейрогенной дисфункции мочеиспускания, а также их профилактика. К таким осложнениям относятся манифестация инфекции мочевыводящих путей (исключая бессимптомную бактериурию), уролитиаз, микроцистис, гидронефротическая трансформация и почечная недостаточность, стриктура уретры и т. д. [11].
Наименьшего риска осложнений со стороны верхних мочевыводящих путей следует ожидать при сохранении резервуарной функции мочевого пузыря с низким внутрипузырным давлением, например при гипотонии детрузора, его достаточной функциональной емкости и нормальном состоянии поперечно-полосатого сфинктера уретры или его гипотонии. В этом случае к хорошим результатам коррекции, в т. ч. улучшению качества жизни спинального пациента, приводит адекватное дренирование нижних мочевых путей, при этом следует руководствоваться международными стандартами и отечественными клиническими рекомендациями. При нарушении функции опорожнения мочевого пузыря вследствие повреждения позвоночника и спинного мозга методом выбора является асептическая периодическая катетеризация. Она подразумевает использование одноразового стерильного лубрицированного катетера. Процедура выполняется самостоятельно или с посторонней помощью каждые 4‒6 ч [12].
Иные методы дренирования мочевого пузыря, такие как приемы Креде или Вальсальвы, длительное использование постоянного мочевого катетера, должны быть строго обоснованы, т. к. несут значительные риски развития вторичных нейрогенных осложнений работы мочевого пузыря, достигающих 34% [13].
Периодическая катетеризация 4‒6 раз в сутки при условии отсутствия выраженных нарушений со стороны верхних мочевыводящих путей, шокового состояния, гнойно-инфекционных процессов в уретре и мочевом пузыре может быть назначена любым специалистом, курирующим пациента. Вопрос о том, когда переводить пациента на периодическую катетеризацию для постоянного уретрального дренажа, находится в стадии обсуждения сообщества специалистов по нейроурологии [14]. Формальных ограничений и четких рекомендаций по срокам нет, однако считается, что при отсутствии противопоказаний и достаточной укомплектованности отделения средним и младшим медицинским персоналом следует избавлять пациента от постоянных дренажей как можно раньше.
Гиперактивный мочевой пузырь, встречающийся на фоне детрузорно-сфинктерной диссинергии и без нее, является другой формой нейрогенного расстройства мочеиспускания вследствие травмы позвоночника и спинного мозга. Если такой тип нарушения клинически проявляется недержанием мочи, то он не несет значительного риска осложнений со стороны верхних мочевыводящих путей. К проблемам нейрогенного гиперактивного мочевого пузыря следует отнести снижение качества жизни.
Детрузорно-сфинктерная диссинергия характеризуется тем, что в момент напряжения мочевого пузыря для его опорожнения происходят различные по силе и продолжительности сокращения внутреннего и наружного сфинктеров уретры, обеспечивающих функцию удержания. В норме сокращения детрузора синхронны с расслаблением этих сфинктеров, что способствует свободному выведению мочи по уретре. Нарушение функции опорожнения в сочетании с высоким внутрипузырным давлением ‒ наиболее опасная форма нейрогенной дисфункции мочеиспускания из-за развития пузырно-мочеточникового рефлюкса, а также возможности структурных повреждений самого мочевого пузыря. В этом случае перед урологом стоят две основные задачи: 1) подавление высокого внутрипузырного давления, 2) обеспечение оттока мочи по уретре.
Для подавления детрузорной гиперактивности в качестве первой линии терапии применяются антихолинергические средства, в дополнение к которым можно назначать препараты из группы бета-3-адреномиметиков [15]. Вторая линия лечения включает инъекционное введение в стенку мочевого пузыря 200 ЕД ботулинического нейропептида. Надо понимать, что терапия направлена на создание низкого внутрипузырного давления в мочевом пузыре, необходимого для нормальной работы верхних мочевых путей. Одним из результатов купирования гиперактивности, особенно при сохранении нормального или повышенного тонуса поперечно-полосатого сфинктера уретры, будет увеличение количества остаточной мочи или отсутствие мочевыделения. Поэтому крайне важно объяснить пациенту необходимость проведения указанной терапии с назначением периодической катетеризации мочевого пузыря.
При своевременной коррекции нарушений мочеиспускания у спинальных пациентов, применении рекомендованного метода отведения мочи, компенсации избыточного внутрипузырного давления вследствие гиперактивности детрузора или детрузорно-сфинктерной диссинергии удается избежать многих вторичных осложнений.
В комплексной программе реабилитационного лечения пациентов с травмой позвоночника и спинного мозга используются методики немедикаментозной коррекции, показавшие различный терапевтический потенциал в ходе исследований. В частности, применение электростимуляции мочевого пузыря с помощью имплантируемых электродов в работе А.В. Лившица и соавт. показало, что создать управляемый акт мочеиспускания невозможно, т. к. возбуждение детрузора распространяется на внутренний сфинктер уретры, моделируя детрузорно-сфинктерную диссинергию [16]. Несмотря на то что исследователи представили некоторые положительные результаты, методика не нашла клинического применения в связи с высокой инвазивностью и риском вторичных осложнений.
Применение электростимуляции переменным пульсирующим током по лонно-сакральной методике и электрофореза с прозерином на передней брюшной стенке в проекции мочевого пузыря в настоящий момент представляется несостоятельным вследствие особенностей физиологии нижних мочевых путей и неучастия мышц живота в акте мочеиспускания.
Перспективно использование современных методик: сакральной инвазивной электронейростимуляции с помощью имплантируемых электродов и ритмической периферической магнитной стимуляции в области сакрального центра мочеиспускания и крестцовых корешков [17, 18]. В настоящее время механизм действия магнитной стимуляции на физиологию нижних мочевых путей остается неясным. Многоступенчатость и сложность нервной регуляции процесса удержания мочи и акта мочеиспускания предполагают возможность вовлечения различных структур в ответ на внешнее воздействие. Клинические и уродинамические эффекты магнитной стимуляции, вероятно, связаны с восстановлением интеграции регуляторных рефлексов, при этом наблюдается эффект нейромодуляции, когда происходит изменение активности (торможение или возбуждение) структур центральной, периферической и вегетативной нервных систем [19, 20].
Нейрогенное нарушение мочеиспускания, обусловленное травмой позвоночника и спинного мозга, клинически чрезвычайно гетерогенно вследствие вариабельности уровня и степени тяжести поражения [21, 22]. Этот аспект диктует необходимость индивидуального диагностического подхода, выбора адекватного метода коррекции работы нижних мочевых путей. Реабилитационный путь спинального пациента в настоящее время невозможно представить без тесного сотрудничества невролога и уролога. Совместный современный подход специалистов к проблеме урологических осложнений травмы спинного мозга обеспечивает пациенту верное понимание собственного состояния и адекватную прогностическую оценку, а также возможность социальной адаптации и повышения качества жизни [23, 24].
Источник
