Ультразвук при переломе челюсти
Изобретение относится к медицине, в частности к травматологии и челюстно-лицевой хирургии. Способ лечения и реабилитации больных с переломами нижней челюсти включает воздействие ультразвуком интенсивностью 0,2 Вт/см2 в непрерывном режиме по лабильной методике, 8 — 10 сеансов на курс, продолжительностью 5 минут с одновременным назначением медикаментозных препаратов, стимулирующих кровообращение (папаверина гидрохлорид, никотиновая кислота, компламин). 3 табл.
Изобретение относится к медицине, в частности к травматологии и челюстно-лицевой хирургии и может быть использовано для лечения переломов нижней челюсти.
Комплексное лечение переломов нижней челюсти включает в себя помимо репозиции и иммобилизации отломков применение физических методов с целью стимулирования процессов остеогенеза и сокращения сроков временной нетрудоспособности у больных [1, 2, 3, 4, 5] В качестве прототипа использован способ, при котором включение в комплекс лечения переломов костей с 3 4 дня э.п. УВЧ, с 5 6 дня соллюкса, с 10 12 дня электрофореза 2% хлорида кальция позволяло ускорить консолидацию отломков [6] Однако, по мнению ряда исследователей [7, 8, 9] ультразвук вызывает в тканях улучшение крово- и лимфообращения, обмена веществ, что усиливает их регенераторные и пластические способности. Это является преимуществом по сравнению с другими физиотерапевтическими методами.
Задачей изобретения является сократить сроки сращения отломков нижней челюсти и сроки реабилитации при переломах по сравнению с лечением традиционными методами.
Указанная задача достигается тем, что при переломах нижней челюсти наряду с общей терапией используется ультразвук с одновременным применением медикаментозных препаратов, стимулирующих кровообращение.
Эти препараты (папаверина гидрохлорид, никотиновая кислота, компламин) обладают выраженным сосудорасширяющим действием, за счет чего улучшается кровенаполнение зоны перелома, способствующее более благоприятному сращению отломков, сокращению сроков лечения.
Способ осуществляется следующим образом: через 2 3 суток после иммобилизации отломков проводят воздействие ультразвуком интенсивностью 0,2 Вт/см2 на область перелома нижней челюсти в непрерывном режиме по лабильной методике, 8 10 сеансов на курс, продолжительностью 5 минут. Одновременно больному назначают медикаментозные препараты, стимулирующие кровообращение: папаверина гидрохлорид, 2 мл 2% раствора, или никотиновой кислоты 1 мл 1% или компламин 2 мл 15% на курс 25 30 инъекций. При необходимости курс лечения повторяют.
Экспериментальное исследование проведено на 24 кроликах, которым моделировали линейный перелом нижней челюсти в области угла справа. 18 животных составили опытную, 6 контрольную группу, в послеоперационном периоде применяли ультразвук различной интенсивности на область перелома. Кролики выводились из опыта через 12, 21, 30, 45 дней, 3 и 6 месяцев.
В результате исследования установлено, что применение ультразвука стимулирует репаративные процессы костной ткани в области перелома нижней челюсти, особенно в ранние сроки после травмы (до 45 дней), причем наиболее активно при озвучивании интенсивностью 0,2 Вт/см2 и меньшей степени 0,4 0,6 Вт/см2.
Оценка эффективности лечения переломов нижней челюсти с применением ультразвука и медикаментозных препаратов, стимулирующих кровообращение, основывалась на клинико-рентгенологических данных, а также на исследовании звукопроводимости (эхоостеометрии) и сократительной способности собственно жевательных мышц (электромиография) в сроки до и после фиксации отломков, через 4 недели, 1,5 3 6 месяцев.
Нами проведены клинические исследования двух групп больных, получавших лечение по предложенному способу и лечение традиционными методами.
В первой группе больных (26) с переломами нижней челюсти различной локализации (36 переломов), получавшей ультразвук и медикаментозные препараты, стимулирующие кровообращение, при поступлении в клинику показатели эхоостеометрии и электромиографии были резко снижены. После фиксации отломков и в ближайшие сроки они оставались по-прежнему на низком уровне. Восстановление звукопроводимости различных отделов нижней челюсти до уровня здоровых лиц наступало к 4 5 неделям с момента травмы, показатели биоэлектрической активности собственно жевательных мышц нормализовались к 3 месяцам (см. табл. 1, клинический пример N 1).
Во второй группе больных (77 человек, 121 перелом) применялись традиционные методы физиотерапевтического лечения (соллюкс, э.п. УВЧ, электрофорез с 5% -ным раствором хлорида кальция через 12 дней, в стадии образования первичной костной мозоли) или оно было не законченным. Восстановление звукопроводимости наступало к 1,5 месяцам, показатели биоэлектрической активности собственно жевательных мышц нормализовались к 6 месяцам (табл. 2, клинический пример N 2).
Одновременное применение ультразвука и медикаментозных препаратов, стимулирующих кровообращение у больных с переломами нижней челюсти, проживающих в районах Европейского Севера, позволило сократить сроки сращения отломков на 3,5 6,2 дня, сроки нетрудоспособности на 2,0 6,0 дня и в 2 раза сроки реабилитации по сравнению с традиционными методами лечения (табл. 3).
Клинический пример N 1. Больной Г. 29 лет, госпитализирован в стоматологическое отделение областной клинической больницы на 2 сутки после травмы. Диагноз: «Перелом нижней челюсти в области угла слева». До иммобилизации отломков больному проведено клинико-рентгенологическое и функциональное обследование. При эхоостеометрическом исследовании нижней челюсти скорость ультразвукового импульса в области перелома была снижена, сократительная способность жевательных мышц снижена с обеих сторон, больше слева. 3.Х. 1986 года произведена репозиция отломков нижней челюсти, наложены бимаксилярные шины Васильева с межчелюстной резиновой тягой. Проводилось лечение ультразвуком и медикаментозным препаратом, стимулирующим кровообращение (папаверина гидрохлорид 2 мл 2%-го раствора). Консолидация перелома наступила через 36 дней. Полное восстановление скорости проведения ультразвукового импульса (2199,6 м/сек2) наступало через 1 месяц (Р> 0,05). Биоэлектрическая активность собственно жевательных мышц к 3 месяцам приблизилась к уровню здоровых лиц (400 мкВ слева и 500 мкВ справа )( Р > 0,05).
Клинический пример N 2. Больной М. 26 лет, госпитализирован в стоматологическое отделение областной клинической больницы на 3 сутки после травмы. Диагноз: «Перелом нижней челюсти в области угла слева со смещением отломков. До иммобилизации отломков больному проведено клинико-рентгенологическое и функциональное обследование. По данным эхоостеометрии скорость прохождения ультразвукового импульса в области травмированного участка была снижена, сократительная способность собственно жевательных мышц была снижена с обеих сторон, больше слева. 30.IV.1986 года произведена репозиция отломков нижней челюсти, наложены бимаксилярные шины Васильева с межчелюстной резиновой тягой. Больной получал традиционные методы лечения (Э.п. УВЧ, далее электрофорез с 2%-м хлоридом кальция в стадии образования первичной костной мозоли). Отмечено удлинение сроков консолидации отломков на 4 дня по сравнению с первым больным. Полное восстановление скорости проведения ультразвукового импульса (2197,8 м/сек2) наступало к 1,5 месяцам (Р > 0,05). Биоэлектрическая активность собственно жевательных мышц (600 мкВ и 900 мкВ) восстановилась лишь к 6 месяцам (Р > 0,05).
Формула изобретения
Способ лечения и реабилитации больных с переломами нижней челюсти, включающий физиотерапевтическое лечение, отличающийся тем, что на область перелома воздействуют ультразвуком интенсивностью 0,2 Вт/см2 в непрерывном режиме по лабильной методике продолжительностью 5 мин, курс 8 10 сеансов с одновременной стимулированием кровообращения путем парэнтерального введения папаверина гидрохлорида 2 мл 2%-ного раствора, или никотиновой кислоты 2 мл 1% -ного раствора, или компламина 2 мл 15%-ного раствора, на курс 25 30 инъекций.
РИСУНКИ
Рисунок 1, Рисунок 2, Рисунок 3, Рисунок 4
Источник
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Омар Х.М.
1
Цымбалов О.В.
1
1 ГОУ ВПО «Кубанский государственный медицинский университет»
Проведено исследование скорости прохождения ультразвуковой волны (СПУВ) через кость нижней челюсти при ее переломе на этапах консервативного и оперативного лечения и консолидации. Доказано, что СПУВ отрицательно коррелирует с величиной диастаза костных отломков, что подтверждается рентгенологически. Установлена положительная взаимосвязь между величиной СПУВ и степенью консолидации костных отломков нижней челюсти, определяемой с помощью бимануальной пальпации. При этом рентгенологические данные при переломах нижней челюсти не отражали характер ранних морфо-структурных регенераторных изменений. Таким образом, эхоостеометрия при переломе нижней челюсти является адекватным диагностическим методом оценки эффективности лечения.
перелом нижней челюсти
эхоостеометрия
1. Бармин В.В. Морфологические аспекты репаративного остеогенеза при переломах нижней челюсти на фоне хронического эндотоксикоза: автореф. … канд. мед. наук. — Волгоград, 2008. — 21 с.
2. Бернадский Ю.И. Травматология и восстановительная хирургия черепно- челюстно-лицевой области. — М.: Мед. литература, 1999. — С. 1-98.
3. Пылков А.И. Ультразвуковая эхоостеометрия челюстных костей. II. Прогнозирование исходов дентальной имплантации // Эхография. — 2002. — №3. — С. 295-298.
4. Рисованный С.И. Эхоостеометрия — метод объективной оценки эффективности высокоинтенсивной лазерной терапии воспалительных заболеваний пародонта // Российский стоматологический журнал. — 2001. — №5. — С. 18-21.
5. Тельных Р.Ю. Использование биологически активных препаратов в профилактике осложнений при лечении больных с открытыми травматическими переломами нижней челюсти // Стоматология. — 2008. — №4. — С. 56-58.
6. Шаргородский А.Г. Травмы мягких тканей и костей лица. — М., 2004. — 207 с.
Травмы челюстно-лицевой области составляют около 8 % всех травматических заболеваний человека [2], среди них на долю переломов нижней челюсти (ПНЧ) приходится 75-90 % [1]. В результате формирования структурно-морфо-функционально неполноценного костного регенерата и присоединения инфекции в 40 % случаев развиваются посттравматические осложнения [5], которые приводят к длительной нетрудоспособности, а иногда к инвалидности [6]. Кроме того, данный вид травматической патологии, к сожалению, встречается в большинстве случаев у молодых лиц трудоспособного возраста. Развитие новых методов лечения, направленных на предупреждение осложнений, ограничивает отсутствие адекватных методов диагностики состояния костной ткани нижней челюсти. Последние, в отличие от рентгенологических методов, должны верифицировать функциональные регенераторные особенности, предшествующие грубой органической патологии. С нашей точки зрения, одним из таких методов может являться эхоостеометрия. Однако представленные в литературе данные по использованию этого метода крайне немногочисленны, особенно при переломах нижней челюсти, и не дают необходимого представления о полном объеме его диагностических возможностей [3, 4].
В связи с этим целью настоящего исследования явилась оценка значимости эхоостеометрии в качестве средства мониторинга лечения ПНЧ.
Материалы и методы исследования
Объектом исследования были 20 добровольцев с интактным пародонтом без общесоматической патологии, которые составили контрольную группу, и 20 пациентов с одиночными переломами в области угла нижней челюсти, которым требовалось оперативное лечение. Группы были сопоставимы по полу и возрасту: от 20 до 40 лет. Диагноз ПНЧ выставлялся на основе клинического и рентгенологического (ортопантомограммы) обследования. Больным с ПНЧ проводили репозицию и иммобилизацию костных отломков путем назубного шинирования с использованием стандартных шин Васильева и межчелюстного эластического вытяжения, назначалось стандартное противовоспалительное лечение. В случае недостигнутой удовлетворительной репозиции, определяемой на рентгенологическом изображении черепа в прямой проекции, больные госпитализировались для проведения накостного остеосинтеза. Оперативное вмешательство выполняли под общим обезболиванием, из-под «окаймляющего» угол нижней челюсти разреза. Проводили скелетирование наружной поверхности тела и ветви нижней челюсти, освобождалась щель перелома от интерпонирующих мягких тканей. Под визуальным контролем осуществлялась репозиция и фиксация костных отломков титановыми минипластинами. Мониторинг клинико- лабораторных показателей осуществляли при обращении не позже 12 часов после перелома; через 7, 14 и 28 дней после операции. Выздоровление пациентов протекало удовлетворительно без осложнений в стандартные сроки. Эхоостеометрию проводили с помощью аппарата ЭОМ-2 в тетраполярном режиме. Результаты на каждом этапе исследования воспроизводились не менее 3 раз. Датчики располагались дистальнее и медиальнее (подбородочный выступ) линии перелома, под углом 90°к поверхности кости с использованием межэлектродного геля. Идентичность степени давления датчиков на мягкие ткани достигалась мануальным опытом работы одного оператора. Достоверность различия средних данных находили с помощью t-критерия Стьюдента (р < 0,05).
Результаты исследования и их обсуждение
Скорость прохождения ультразвуковой волны (СПУВ) по телу нижней челюсти у здоровых лиц, в среднем, составила 2483,0 ± 34,12 м/с. Справа скорость была несколько выше, чем слева — 2493,2 ± 45,76 против 2472,8 ± 52,12 м/с (р > 0,05).
При обращении у всех больных с ПНЧ со смещением, что подтверждалось рентгенологически, на стороне перелома было обнаружено достоверное снижение СПУВ относительно контроля (рисунок) до 1694,2 ± 27,34 м/с. Снижение СПУВ было обусловлено нарушением непрерывности кости нижней челюсти, наличием диастаза, интерпозицией мягких тканей, т.к. основным субстратом распространения ультразвуковой волны является именно кость нижней челюсти. Была обнаружена отрицательная обратная связь между величиной диастаза и СПУВ — коэффициент корреляции Пирсона (Кк) оказался равным ‒0,76. После оперативного остеосинтеза, когда репозиция и иммобилизация костных отломков подтверждалась под контролем зрения, было обнаружено достоверное относительно предыдущего этапа исследования увеличение СПУВ — до 1904 ± 64,75 м/с. Тем не менее величина СПУВ имела существенно более низкое значение, чем в группе контроля.
Скорость ультразвуковой волны на этапах лечения: I — при обращении; II — после оперативного остеосинтеза, III — через 7 дней; IV -через 14 дней; V — через 28 дней; ПНЧ — переломы нижней челюсти
В ранние послеоперационные сроки определялось умеренное серозно-сукровичное отделяемое из раны. В связи с удовлетворительным общим и местным статусом мягкий дренаж удалялся на 2-3 послеоперационные сутки, швы снимали на 7-10 день. Межчелюстное вытяжение меняли каждые 5 дней.
В динамике благоприятного лечения величина СПУВ восстанавливалась (см. рисунок) и уже к 28 дню показатели входили в зону 1,5-сигмальных отклонений от контрольной группы. В этот срок курации больные жалоб не предъявляли, наблюдалась удовлетворительная консолидация отломков. В большинстве случаев снималось межчелюстное эластическое вытяжение. При этом следует отметить, что визуальных принципиальных отличий в течение 4-х недель наблюдения от контрольной рентгенограммы после остеосинтеза не определялось. Таким образом, в целом установлена положительная тесная взаимосвязь между величиной СПУВ и степенью консолидации костных отломков нижней челюсти, определяемой с помощью бимануальной пальпации. При этом рентгенологические данные при переломах нижней челюсти не отражали характер ранних морфо-структурных регенераторных изменений.
Выводы
У больных с переломами нижней челюсти скорость распространения ультразвуковой волны непосредственно через линию перелома тесно, с высокой степенью обратной связи коррелирует с величиной диастаза костных отломков и может служить альтернативным критерием факта смещения отломков. Кроме того, эхоостеометрия может служить основанием для принятия решения о необходимости оперативного лечения при невозможности рентгенологического контроля в разных плоскостях исследования.
Скорость распространения ультразвуковой волны через линию перелома может также служить неинвазивным, неагрессивным аппаратно-инструментальным методом диагностики эффективности репозиции и надежности иммобилизации.
Скорость распространения ультразвуковой волны является адекватным функциональным методом диагностики сбалансированности неоостеогенеза, организации и формирования костного регенерата в линии перелома.
Рецензенты:
Попков В.Л., д.м.н., профессор, профессор кафедры ортопедической стоматологии ГБОУ ВПО «Кубанский государственный медицинский университет» Минздравсоцразвития России, г. Краснодар;
Рисованный С.И., д.м.н., профессор, профессор кафедры стоматологии ФПК и ППС ГБОУ ВПО «Кубанский государственный медицинский университет» Минздравсоцразвития России, г. Краснодар.
Работа поступила в редакцию 10.09.2011.
Библиографическая ссылка
Омар Х.М., Цымбалов О.В. УЛЬТРАЗВУКОВАЯ ДИАГНОСТИКА КАК МЕТОД ПЛАНИРОВАНИЯ ЛЕЧЕНИЯ БОЛЬНЫХ С ПЕРЕЛОМАМИ НИЖНЕЙ ЧЕЛЮСТИ И ОЦЕНКИ РЕПАРАТИВНОГО ОСТЕОГЕНЕЗА // Фундаментальные исследования. – 2011. – № 10-3. – С. 542-544;
URL: https://fundamental-research.ru/ru/article/view?id=28911 (дата обращения: 11.07.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
Шинирование челюсти – это ее фиксация в неподвижном состоянии. К такой мере прибегают ортопеды при переломах кости, что гарантирует правильное срастание и ускоряет процесс реабилитации. Лечение пациентов с такой травмой вызывает сложности. Методика шинирования позволяет добиться абсолютной иммобилизации, сводит риск осложнений к минимуму.
Виды шинирования челюсти
Вид шинирования определяет врач в индивидуальном порядке, в зависимости от сложности перелома.

На выбор метода влияют такие факторы:
- смещение отломков;
- дробление кости;
- степень повреждения зубов и мягких тканей;
- местно локализации перелома;
- возможность реконструкции костных отломков или остеосинтез (внедрение искусственных фиксаторов).
Как проходит наложение шины при переломе челюсти
Все манипуляции по установке фиксирующей конструкции проводят под местным обезболиванием.
Одностороннее шинирование
Эффективным способом шинирования при переломе нижней челюсти является односторонняя фиксация. Для создания неподвижности используют конструкции из изогнутых проволок. Их закрепляют у основания коронки жевательных зубов для фиксации челюсти в анатомически правильном положении.
Способ частично сохраняет физиологическую подвижность, которая необходима для жевания. Это щадящий метод лечения, который не доставляет пациентам сильного дискомфорта.
Двухстороннее шинирование
Шина устанавливается на верхнюю и нижнюю челюсть. Для репозиции костных фрагментов используют гладкие скобы или шины с распорочным изгибом. Конструкция крепится с помощью зацепных петель и имеет межчелюстные тяги.
Такие иммобилизационные средства готовят для каждого пациента отдельно. При правильном изготовлении шина должна:
- проходить по линии шеек зубов;
- прикасаться к каждому зубу;
- в точности повторять кривизну прикуса;
- не должна травмировать десневые сосочки;
- не должна пружинить.
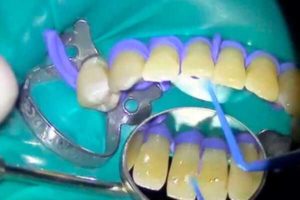
При двустороннем шинировании также применяют шину Васильева – лента с зацепными петлями из нержавеющей стали.
Двухчелюстное шинирование
Для одновременной фиксации обеих челюстей используют парные элементы – конструкции с крючками и резиновыми кольцами для плотного прижатия костей, стягивания.
С целью лечения переломов со смещением пациентам устанавливают конструкции с распорками. Они предотвращают деформацию зубного ряда и самой челюсти. Эластичные лигатуры безопасные, надежные и простые в наложении на травмированные участки.
Показания к двусторонней иммобилизации
- полный разлом верхней челюсти;
- множественные переломы;
- риск внутричерепных осложнений.
Перед шинированием
Перед лечебной иммобилизацией проводят тщательную диагностику, выявляют степень разрушения челюсти, целостность зубов.
Случаи, при которых зубы могут удалить:
- выраженное расшатывание зуба с надломом корневой зоны;
- повреждение с последующим гнойным воспалением;
- зуб, не подлежащий эстетическому восстановлению;
- вколачивание в челюсть;
- если зубы мешают установке шин.
Если есть возможность сохранить свои зубы, пациентам проводят процедуру шунтирования челюсти. Зубной ряд фиксируют с помощью приспособлений, позволяющих надолго сохранить их неподвижность. Если зубные корни отходят от лунок, не прилегают плотно к мягким тканям – это прямое показание к шунтированию.
Используемые материалы

В большинстве случаев применяют лигатурную проволоку из нержавеющей стали, меди. Это доступный и недорогой способ восстановления целостности костей.
Если отломки смещены, используют средства для остеосинтеза – мини-пластины, шурупы, винты, скобы со специально заданными свойствами. При оскольчатых переломах нижней челюсти применяют быстротвердеющие пластмассы.
Как проходит лечение
Шинирование челюстей при переломах – это начальный этап продолжительного лечения и реабилитации. Сложность наложения фиксаторов зависит от выбранной конструкции.
При неосложненных переломах на челюсть накладывают шину, закрепляют ее на жевательных зубах. Если происходит иммобилизация двух челюстей, их соединяют резиновыми лигатурами, что обеспечивает неподвижность.
Алгоритм наложения шины Тигерштедта (назубная):
- Подкожно ввести атропин, это снизит выработку слюны во время проведения манипуляции.
- Провести местную анестезию
- Шину изгибать постепенно, слева направо (некоторые врачи изгиб начинают с места перелома).
- Во время изгибания шину держат правой рукой с помощью специальных крампонных щипцов, левой рукой задают нужную форму.
- После примерки на зубах, дальнейшее формирование шины производится не во рту.
- Готовая шина должна прилегать к каждому зубу и располагаться в нижней половине коронки.
- Конструкцию фиксируют лигатурной проволокой (закручивают по часовой стрелке).
Остеосинтез – хирургический метод лечения переломов. Он проводится открытым и закрытым способом. Бывает очаговый (фиксатор пересекает щель разлома) и внеочаговый (фиксаторы крепятся над переломом) остеосинтез.
Сколько ходить с шинами при переломе челюсти
 Процесс сращения костей — длительный. С учетом трудностей создания абсолютной неподвижности, больших рисков повторного смещения костных отломков больные вынуждены носить конструкцию во рту несколько месяцев.
Процесс сращения костей — длительный. С учетом трудностей создания абсолютной неподвижности, больших рисков повторного смещения костных отломков больные вынуждены носить конструкцию во рту несколько месяцев.
При частичном переломе или трещине иммобилизация может длиться 1,5-2 месяц при условии строгого соблюдения режима и выполнении всех рекомендаций врача. Восстановление после осложненных травм длится от 6 месяцев до года. Все это время больной вынужден носить фиксаторы.
Длительное обездвиживание также показано при массивном повреждении зубов. Возвращение зубного ряда в нормальное состояние занимает не менее 12 месяцев. При уменьшении этого срока сохраняется подвижность корневой зоны.
Когда снимают шины
Показание к снятию шин – рентгенологический снимок, подтверждающий полное сращение костей, образование костной мозоли. Перед тем, как снять шину, лечащий врач также учитывает вероятность развития посттравматических осложнений – вторичное смещение отломков, ложный сустав, деформация челюстей.
После оценки всех факторов, результатов анализов, доктор принимает решение, когда снимут шины.
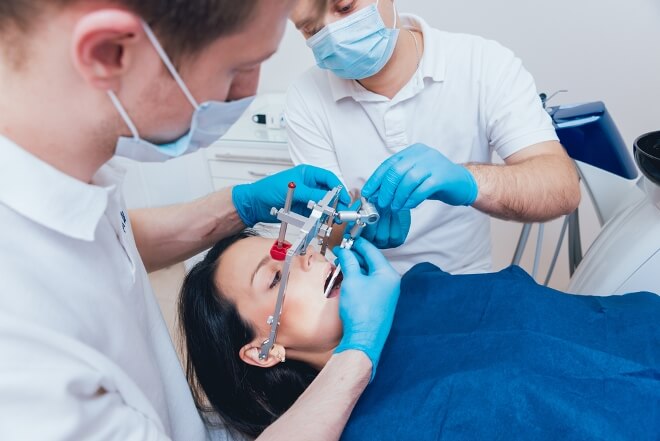
Как снимают шины после перелома челюсти
После продолжительного ношения конструкции во рту у пациентов может возникнуть вопрос, больно ли снимать шину с челюсти. У специалистов эта манипуляция не вызывает сложности.
Затруднения могут возникнуть при развитии контрактур (ограничение движений в нижнечелюстном суставе). При необходимости открыть рот возникают болевые ощущения разной интенсивности. Это неизбежные последствия при длительной неподвижности сустава.
Некоторые люди испытывают только дискомфорт. Это зависит от того, сколько они ходили с конструкцией в ротовой полости, болевого порога нервной системы.
После снятия шин в обязательном порядке проводят профессиональную гигиеническую чистку (санацию) ротовой полости. При обнаружении хронических очагов инфекции (кариес) пациент проходит стоматологическое лечение.
Восстановительный период
Период восстановления функциональности челюстей зависит от таких факторов:
- степень тяжести, вид перелома;
- продолжительность лечения;
- отсутствие или наличие осложнений;
- возраст пациента;
- наличие сопутствующих внутренних болезней.
Возвращение полноценного функционирования сустава не всегда возможно. Здесь на первый план выходит ответственность и исполнительность самого пациента. Чтобы вернуть здоровую работу челюсти, необходимо строго соблюдать все прописанные рекомендации. Длительная, скрупулезная реабилитация – залог нормальной деятельности челюстных суставов.
Реабилитационные мероприятия:
- ЛФК для разработки суставов. Все упражнения выполняются с полной амплитудой даже при болевых ощущениях;
- регулярные курсы лечебного массажа;
- физиотерапевтические процедуры – аппликации парафина, грязелечение, ультразвук, электрофорез с кальцием, УФ-облучение в зимнее время;
- щадящая пища.
Правильное питание после шинирования
После снятия шин важно правильно питаться в домашних условиях. Принимаемая пища должна быть мягкой, перетертой, вареной или запеченной, не требующей активного пережевывания.
После длительного нахождения фиксаторов во рту у пациентов часто развивается чувствительность зубной эмали. Поэтому не рекомендуют употреблять горячую, холодную, кислую, соленую, острую пищу.
На фоне жидких блюд постепенно вводится пюреобразная еда. Можно употреблять запеченные овощи, фрукты, рыбу. Первое время исключить мясо, включая нежные сорта птицы. Отварное мясо можно измельчать блендером и употреблять в составе супов, в качестве пюре.
Чтобы человек получал необходимое количество полезных нутриентов, в рацион вводят белковые коктейли, творог, муссы из каш, пудинги с грибами, яйцами, рисом, сыром, молотыми орехами.
Рекомендации по питанию:
- первое время используйте трубочку для употребления пищи;
- обогатите рацион кальцием;
- обеспечьте высокую калорийность приготовленных блюд;
- восполняйте потребность организма в полезных веществах с помощью витаминных комплексов в виде растворимых шипучих таблеток Омега-3 в жидкой форме.
Шинирование челюстей при переломах – единственный эффективный способ лечения травмы. Методику используют во всех передовых отечественных и зарубежных клиниках. Обездвижение создает дискомфорт на протяжении всей терапии и сопряжено с посттравматическими осложнениями. При качественном лечении и правильной реабилитации человек со сломанной челюстью полностью восстанавливается и возвращается к нормальной деятельности.
Источник
