Перелом костей у недоношенных
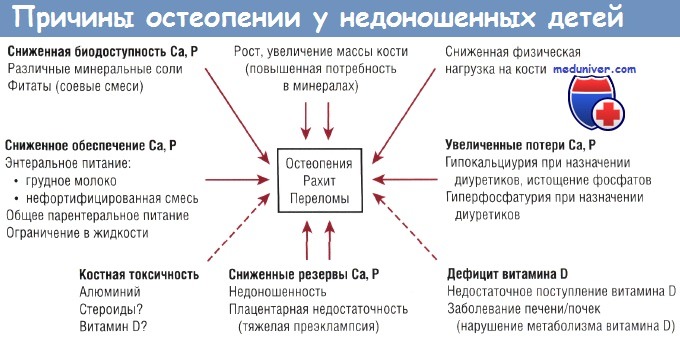
Остеопения и рахит недоношенных новорожденных детей — клиника, диагностика, лечение
Заболевание вызвано сочетанным дефицитом кальция (и фосфора) и витамина D у недоношенных детей. Остеопения недоношенных — это метаболическое заболевание костной ткани, связанное с низкой минерализацией костей скелета. В патогенезе может иметь значение нарушение минерализации зон роста кости, поэтому термины «остеопения недоношенных» и «рахит недоношенных» в литературе часто используют как взаимозаменяемые.
У недоношенных детей после рождения скорость минерализации костей скелета замедлена по сравнению с таковой во внутриутробном периоде, подобно тому как замедляется во внеутробном периоде скорость роста. Наиболее тяжелое осложнение указанной патологии — переломы костей. Чаще всего отмечаются переломы ребер, но переломы длинных трубчатых костей встречаются редко.
Остеопения/рахит отмечается практически у каждого недоношенного ребенка, родившегося с массой тела менее 1500 г. Наиболее тяжелые по состоянию недоношенные дети имеют наиболее выраженную остеопению. Таким образом, частота возникновения рахита (иногда переломов костей) в целом обратно пропорциональна массе тела при рождении. Если тщательно проанализировать результаты рентгенографии, то частота переломов у недоношенных детей колеблется от 20 до 32%. У детей, имеющих массу тела при рождении менее 1000 г, она возрастает до 50-60%.
Описания гистологических изменений при данной патологии немногочисленны. Считается, что ее этиология предполагает участие многих факторов. Как уже было указано ранее, наиболее значимым фактором являются ограниченные запасы кальция (и фосфора) в костной ткани при рождении, а также сниженная скорость минерализации кости по сравнению с внутриутробным периодом.
Остеопения отмечается даже в тех случаях, когда недоношенные дети в качестве питания получают специально разработанные для младенцев с ОНМТ смеси с высоким содержанием минералов или фортификаторы грудного молока.
В опубликованных в последнее время обзорах есть доказательства роли сниженной нагрузки на кость в возникновении остеопении недоношенных. У данной категории младенцев нагрузка на кость ограничена выполнением пассивных или активных мышечных движений. Увеличение нагрузки на кость (например, в виде пассивных движений с вовлечением в работу суставов) способствует формированию костной ткани, в то время как снижение нагрузки (уменьшение физической активности) ведет к резорбции кости.
Две линии доказательств указывают на важность нагрузки на кость у недоношенных детей. Во-первых, было выявлено повышение уровня биохимических маркеров резорбции кости у недоношенных детей (гидроксипролина, телопептида коллагена типа 1, щелочной фосфатазы). Во-вторых, исследования показали, что внедрение программ, стимулирующих пассивную физическую нагрузку у недоношенных детей, улучшает параметры минерализации костной ткани. Удивительно, но программы пассивных упражнений показали свою эффективность, даже если применяли кратковременные упражнения (5-10 мин/сут).
С другой стороны, дефицит витамина D не является частой причиной заболевания костной ткани у недоношенных детей в тех группах, где есть «насыщение» по витамину D. Недоношенные дети с остеопенией обычно имеют нормальные уровни 25(OH)D и повышенные уровни l,25(OH)2D. Пероральный прием витамина D в дозе 2000 ME/ сут в течение 6 нед не влияет на частоту возникновения остеопении у недоношенных детей, что позволяет говорить об адекватности дозы 200-400 МЕ/сут. Другие составляющие патогенеза остеопении недоношенных показаны на рисунке.

Диагноз «остеопения» ставят на основании результатов рентгенологического и лабораторного обследования. Физикальное обследование не столь значимо для выявления заболевания, за исключением тех стадий его развития, когда можно обнаружить крепитацию и припухлость в местах переломов длинных костей. В более старшем возрасте можно выявить рахитические четки в зонах костно-хрящевого соединения и краниотабес.
Поскольку опора на ноги в этом возрасте не столь значима, те очевидные симптомы рахита, которые проявляются искривлением нижних конечностей у детей старшего возраста, не имеют клинического значения.
В большинстве случаев остеопению диагностируют при проведении рутинной рентгенографии, когда выявляют выраженную гипо-минерализацию или признаки произошедших ранее переломов ребер. В случае более тяжелых форм заболевания на стандартных рентгенограммах костей запястья и коленей могут быть видны классические признаки рахита, но обычно они не заметны до двухмесячного возраста ребенка.
Следует указать, что стандартная рентгенография не способна выявить сниженную минерализацию костной ткани до того момента, пока не произойдет потеря 30-40% минерального состава костной ткани. Для проведения в исследовательских целях диагностики костных изменений у недоношенных детей более подходящими считают технологии, обладающие специфической чувствительностью, такие как одиночная фотонная абсорбциометрия, двойная энергетическая рентген-абсорбциометрия, количественная компьютерная томография и трансмиссионная ультразвуковая диагностика.
Для диагностики остеопении недоношенных применяют ряд биохимических маркеров сыворотки крови. Они включают кальций, фосфор, щелочную фосфатазу, паратиреоидный гормон, 25(OH)D, l,25(OH)2D и остеокальцин. Исследуя мочу, можно оценить фракционную экскрецию кальция и тубулярную реабсорбцию фосфата, а также отношение кальций/креатинин. Низкую концентрацию фосфора в сыворотке (менее 45 мг/л) можно считать наилучшим индикатором дефицита минералов у данной категории детей.
Согласно рекомендациям Комитета по питанию Американской академии педиатрии (American Academy of Pediatrics Committee on Nutrition) и некоторых других организаций, в США и Канаде младенцам с ОНМТ, имеющим остеопению, не рекомендуют назначение суточной дозы витамина D более 200-400 ME.
Высокие концентрации l,25(OH)2D и нормальные уровни 25(OH)D практически у всех детей, имеющих указанную патологию, подтверждают правильность упомянутых рекомендаций; детям с ОНМТ не следует назначать в качестве питания продукты, содержащие неадекватное количество кальция и фосфора, например нефортифицированное грудное молоко. Увеличение суточной дозы витамина D до 960 ME и выше не подтвердило эффективности. Потребности в витамине D при парентеральном его введении еще менее ясны.
Впрочем, при использовании современных мультивитаминных препаратов для парентерального введения сложно превысить суточную дозу витамина D 400 ME, не вызывая одновременно передозировки других витаминов-компонентов комплексного препарата. Тем не менее недоношенные дети, длительно получающие полное парентеральное питание, имеют адекватный статус по витамину D даже при получении его в дозе 30-35 МЕ/кг/сут.
Несмотря на то что получены доказательства пользы физической нагрузки (при выполнении пассивных мышечных движений), наиболее важным компонентом профилактики и лечения остается адекватное обеспечение ребенка кальцием и фосфором, без которого любые физические нагрузки на кость будут неэффективными. Вполне логично, что при расчете необходимой дозы минералов преследуют цель достижения скорости минерализации кости, характерной для таковой у плода.
Для этого ребенку необходимо получать энтеральным путем кальций в дозе примерно 200 мг/кг/сут и фосфор в дозе 90 мг/кг/сут, принимая во внимание, что усваивается только 65% кальция (в лучшем случае) и 80% фосфора.
Существуют специальные смеси для детей с ОНМТ, которые позволяют удовлетворить указанные потребности в минералах. Можно также использовать готовые фортификаторы грудного молока, содержащие определенное количество кальция и фосфора. Как уже было сказано ранее, у детей с ОНМТ в первые 8 нед жизни довольно сложно добиться скорости минерализации кости, соответствующей таковой во внутриутробном периоде.
Однако при назначении ребенку кальция и фосфора в указанных ранее дозах можно предотвратить развитие тяжелого рахита и остеопении с переломами костей. Следует отметить, что «наверстывание» минерализации кости будет происходить у этих младенцев еще в течение многих месяцев после выписки из стационара.
Как уже было сказано, профилактика и/или лечение остеопении у детей с ОНМТ, получающих полное парентеральное питание, служит основанием для более пристального внимания к введению некоторых внутривенных растворов. Концентрации кальция и фосфора в них не позволяют достигнуть внутриутробной скорости минерализации кости.
Однако используемые для парентерального питания препараты все же позволяют предупредить переломы костей и развитие рахита. Применение внутривенных препаратов, содержащих 15 ммоль (60 мг/дл) кальция и 15 ммоль (46 мг/дл) фосфора, может способствовать достижению желаемых показателей минерального гомеостаза (как биохимических маркеров, так и уровня кальциотропных гормонов).
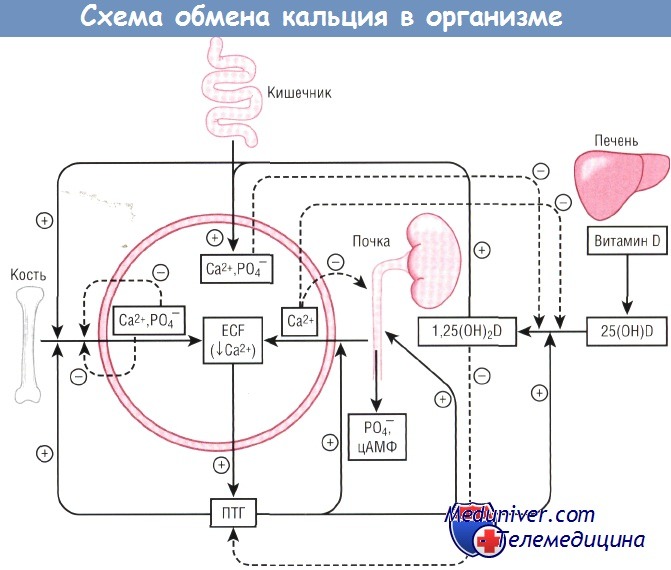
Схема гомеостаза кальция, демонстрирующая взаимодействия между кальцием, кальциотропными гормонами и системой органов.
1,25(OH)2D—1,25-дигидроксивитамин D;
25(OH)D—25-гидроксивитамин D;
ECF — эргокальциферол;
ПТГ — паратиреоидный гормон;
цАМФ — циклический аденозинмонофосфат.
Рахит, обусловленный дефицитом витамина D
В США встречаются случаи рахита у детей ранней возрастной группы, связанные с неадекватным поступлением в организм витамина D и дефицитом солнечного света. Обычно причиной служит выраженный гиповитаминоз D.
Большинство указанных случаев заболевания относились к детям, находящимся исключительно на грудном вскармливании без дополнительного введения витамина D. Следует отметить, что содержание витамина D в грудном молоке минимально. Анализируя случаи рахита у детей, можно отметить, что у этих младенцев часто наблюдалась повышенная пигментация кожи, а также они редко находились под воздействием солнечного света.
Вместе с тем на многих территориях США в зимние месяцы воздействие солнечного света не может считаться достаточно эффективным для синтеза витамина D в коже. Рекомендации по профилактике гиповитаминоза D заключаются в обеспечении всех детей, находящихся на грудном вскармливании, витамином D в дозе 200-400 МЕ/сут до тех пор, пока они не смогут получать адекватное количество витамина D из витамин D-фортифицированных смесей или другой пищи.
— Также рекомендуем «Потребность в витамине А у новорожденных детей»
Оглавление темы «Потребности в витаминах у детей»:
- Потребности в кальции и витамине Д у новорожденных детей
- Ранняя гипокальциемия недоношенных новорожденных детей — клиника, диагностика, лечение
- Остеопения и рахит недоношенных новорожденных детей — клиника, диагностика, лечение
- Потребность в витамине А у новорожденных детей
- Дефицит витамина А и его токсичность у новорожденных детей
- Влияние больших доз витамина А на недоношенных новорожденных детей
- Физиология обмена витамина Е и его эффекты
- Потребность в витамине Е у новорожденных детей
- Дефицит витамина Е у новорожденных детей — клиника, диагностика
- Влияние больших доз витамина Е на недоношенных новорожденных детей
Источник
Клинические проявления
Остеопения клинически проявляется в возрасте от 6 до 12 недель. Обычно патология протекает бессимптомно, однако возможны тяжелые проявления. А. Тяжелое течение
- Плохое увеличение веса и отставание в росте.
- Рахит (задержка роста, краниотабес, выступ реберно-хря-щевого соединения (рахитические четки) и увеличение эпифиза.
- Переломы могут проявляться в виде реакции новорожденного на боль при пальпации.
- Дыхательная недостаточность или отсутствие возможности отлучения пациента от вентиляционной поддержки (на фоне плохой комплаентности грудной клетки).
Б. Последствия остеопении. Остеопения на фоне недоношенности может привести к близорукости. Возможны изменения формы черепа. В детстве при рахите дети меньше своих сверстников, отмечается снижение внутрикостной минерализации и плотности, увеличение экскреции кальция с мочой. VI. Диагностика
А. Рентгенографические признаки носят субъективный характер. Чаще всего остеопения распознается именно на рентгенограмме. В 20—40% отмечается снижение минерализации костей. Можно визуализировать тонкие «размытые» и «рыхлые» кости, крупнопетлистый рисунок кости вследствие рассасывания отдельных костных балок и увеличения костномозгового пространства, участки разрежения в конце длинных костей. В ряде случаев имеют место признаки поднадкостничных переломов. С целью определения тактики дальнейшего лечения необходимо выполнение серийных рентгенограмм в возрасте 3-4 недель.
Биохимические маркеры костного обмена
Маркеры костной активности
а. Кальций. Уровень кальция может оставаться нормальным до развития поздней стадии заболевания.
б. Фосфор. Уровень фосфатов в сыворотке крови очень низок (< 3 мг/дл). Низкий уровень фосфата имеет низкую чувствительность, но высокую специфичность. Низкие уровни неорганического фосфата (РО < 1,8 ммоль/л с повышенным уровнем щелочной фосфатазы может быть более ценным и конкретным исследованием, необходимым для диагностики недостаточного потребления фософора.
в. Уровень щелочной фосфатазы (ALP). Сывороточный ALP является суммой трех изоформ (печени, кишечника и костей). Костная изоформа способствует развитию остеопении в наибольшей степени (90%). ALP у детей иногда в пять раз выше нормальных значений взрослого человека. Высокий уровень может быть связан как с осте-областной патологией, так и с нарушением активности остеокластов. Исследование уровня костноспецифичес-кой иаоформы не целесообразно для определения чувствительности при прогнозировании развития остеопении.
- Повышенные уровни ALP можно увидеть при нормальном росте, излечении рахита, переломах или медной недостаточности.
- Низкие уровни имеют место при дефиците цинка, тяжелой недостаточности питания и врожденной гипо-фосфатазии.
- ALP отрицательно коррелирует с фосфатами; высокие уровни (> 1200 ед./л) связаны с небольшим ростом в детстве.
- Изолированное повышение уровня ALP без Са и Р может в младенческом возрасте наблюдаться при тран-зиторной гиперфосфатаземии.
г. С-терминальный проколлагеновый пептид или коллагеновый пропептид типа I у недоношенных детей коррелирует с оборотом коллагена и формированием костной ткани.
д. При остеопении повышается уровень 1,25-дигидрокси-витамина D.
е. Регулярное определение уровня сывороточного витамина D не требуется.
ж. Уровень остеокальцина может быть повышен.
Маркеры костной резорбции
- а. Мочевой кальций и фосфор. У экстремально недоношенных наблюдается низкий почечный порог для фосфата и увеличение его экскреции даже при низком сывороточном уровне фосфатов. Высокая тубулярная резорбция фосфата предполагает недостаточное его потребление. Экскреция кальция с мочой > 1,2 ммоль/л и неорганического фосфора > 0,4 ммоль/л свидетельствуют о высоком приросте костной ткани.
- б. Карбоксиконцевой перекрестный коллагеновый телопептид типа I (ICTP). У коллагенов типов I, И, Ш и IX была найдена структура их боковых цепей — пиридино-лин и дезоксипиридинолин. Пиридинолины не распадаются в процессе костной резорбции, они циркулиру
крови как часть белковых фрагментов и экскретируются в мочу в виде свободных и белково-связаяных придинолинов. Пиридинолин находят в кости, хряще и в малых количествах в других типах коллагена. Данные маркеры являются маркерами костной резорбции, но получили ограниченное клиническое использование. В. Двухфотонная рентгеновская абсорбциометрия. Двухфотонная абсорбциометрия обладает высокой точностью измерений, минимальной лучевой нагрузкой, что позволяет проводить повторные сканирования для оценки скорости потери костной массы. Исследование хорошо проверено и является «золотым» стандартом для оценки состояния минерализации костной ткани, а также позволяет определить риск переломов у новорожденных. Тем не менее ограничения использования методики и сложности в интерпретации данных препятствуют ее широкому клиническому применению. - Г. Количественная КТ позволяет определить истинный объем плотности кости. Ограничения клинического использования аналогичны ограничениям двухфотонной рентгеновской аб-сорбциометрии.
- Д. УЗИ. Количественное УЗИ может быть выполнено с широкополосными ультразвуковыми измерениями, измерением скорости возвращения сигнала, временем костной трансмиссии.
- УЗИ обладает несколькими преимуществами, включая легкий доступ и отсутствие воздействия ионизирующего излучения. При исследовании используются периферические участки, такие как пяточная кость и кости голени. Имеется возможность количественного и качественного измерения костных свойств, таких как минерализация и корковая толщина кости соответственно.
- Чаще всего УЗИ выполняется как у недоношенных детей, так и у рожденных в срок (скорректированный возраст) для выявления снижения внутрикостной минерализации ткани. Отмечена обратная корреляция между скоростью возврата УЗИ сигнала от болыпеберцовой кости при рождении и сывороточным уровнем щелочной фосфатазы.
Одно- и двуфотонная абсорбциометрия используется для оценки костного содержания минеральных веществ, но имеет ограниченное клиническое применение.
Ведение пациентов
- А. Кормление и нутриционные особенности. Начало раннего эн-терального питания, снижение продолжительности парентерального питания, обогащение человеческого молока (особенно для кормления недоношенных) с помощью специализированных молочных смесей может снизить риск развития остеопении. Для усиления минерализации костной ткани у новорожденного после его выписки из неонатального отделения использование специально разработанных молочных смесей для кормления недоношенных (см. гл. 9, в которой представлена информация по питанию) и обогащения человеческого молока. Для достижения адекватного удержания уровней Са2+ и Р в диапазоне от 60-90 мг/кг/сут. (100-160 мг/кг/сут. фосфата обеспечивают адекватную биодоступность) до 60-90 мг/кг/сут. Следует избегать добавления обогащенных молочных смесей непосредственно в молоко (образуется осадок). Также имеет важное значение адекватное потребление витамина D.
- Б. Крайне важно предотвратить развитие недостаточности витамина D у матерей. В течение гестации потребности в потреблении витамина D варьируют от 150 до 1000 МЕ/сут.
- В. Стимуляция. Механическое раздражение в результате пассивных упражнений способствует улучшению минерализации костей. Однако по данным исследований, результаты противоречивы. В отдельных исследованиях у некоторых новорожденных было зарегистрировано увеличение внутрикостной минерализации ткани и роста костей. Однако стандартное использование программы физической активности у недоношенных детей не оправдано.
- Г. Минимизировать использование фуросемида, кортикостерои-дов. Лишь теоретическое преимущество получило использование тиазидных диуретиков.
- Д. Мальабсорбция. У новорожденных с риском холестаза и мальабсорбцией положительный эффект имеют дополнительные добавки жирорастворимых витаминов и использование специализированных молочных смесей, которые облегчают впитывание жиров.
Прогноз
Остеопения недоношенных успешно поддается профилактике и лечению. В костной ткани минерализация у экстремально недоношенных новорожденных на 25—70% ниже, чем у доношенных младенцев. Минерализация у данной категории пациентов происходит в 6-месячном возрасте. Долгосрочные результаты предполагают дальнейший рост костей и восстановление костной плотности.
Источник
