Физиология перелома

В данной главе представлены биологические и биомеханические основы лечения переломов. Мы рассмотрим, как сломанная кость ведет себя в разных биологических и механических условиях и как это влияет на выбор хирургом метода лечения.
Любое хирургическое вмешательство может изменить биологические условия, а любой метод фиксации — изменить механические условия.
Эти изменения способны оказывать значительное влияние на сращение перелома и определяются хирургом, а не пациентом.
Поэтому каждый хирург-травматолог должен обладать базовыми знаниями по биологии и биомеханике сращения переломов, чтобы принимать, правильные решения при их лечении.
Главная цель внутренней фиксации — срочное и, если возможно, полное восстановление функции поврежденной конечносги.
Хотя надежное сращение перелома является лишь одним из элементов функционального восстановления, его механика, биомеханика и биология важны для достижения хорошего результата.
Фиксация перелома — это всегда компромисс: в силу биологических и биомеханических причин часто необходимо в некоторой степени жертвовать прочностью и жесткостью фиксации, а оптимальный имплантат не обязательно должен быть самым прочным и жестким.
В критических условиях механические требования могут быть важнее биологических, и наоборот. Аналогично, при выборе материала имплантата приходится идти на компромисс: например, выбирать между механической прочностью и пластичностью стали и электрохимической и биологической инертностью титана.
Хирург определяет, какая комбинация технологий и оперативных методов наиболее полно соответствует его опыту, имеющимся условиям и, главное, потребностям пациента.
Характеристики кости
Кость служит опорой и защитой для мягких тканей и обеспечиваег движения и механическую функцию конечности.
При обсуждении переломов и их заживления особый интерес представляет хрупкость кости: кость прочна, но ломается при незначительных деформациях.
Это означает, что кость ведет себя скорее как стекло, а не как резина. Поэтому в начале естественного процесса сращения костная ткань не может сразу перекрыть щель перелома, который постоянно подвергается смещениям.
При нестабильной или эластичной фиксации переломов (относительной стабильности) последовательность биологических событий — в основном сначала формирование мягкой, затем жесткой мозоли — помогает уменьшить нагрузку и деформацию регенерирующих тканей.
Резорбция концов костных отломков увеличивает межотломковую щель. Пролиферирующая ткань менее ригидна (чем костная), что уменьшает механическое напряжение в зоне перелома. Условия микроподвижности способствуют образеванию костно-хрящевой муфты, которая повышает механическую стабильность перелома. После достижения надежной фиксации перелома мозолью происходит полное восстановление функции. Затем за счет внугренней перестройки восстанавливаете! иасодная структура кости — процесс, который может занять годы.
Перелом кости
Перелом — это результат однократной или повторяющейся перегрузки. Собственно перелом возникает в течение доли миллисекунды.
Он приводит к предсказуемому повреждению мягких тканей вследствие их разрыва и процесса типа имплозии — «внутреннего взрыва». Мгновенное разъединение поверхностей перелома приводит к вакуум-эффекту (кавитации) и тяжелым повреждениям мягких тканей
Механические и биохимические явления
Перелом вызывает нарушение непрерывности кости, что приводит к патологической подвижности, потере опорной функции кости и к боли. Хирургическая стабилизация можег немедленно восстановить функцию кости и уменьшить боль, при этом пациент получит возможность безболезненных движений и избежит таких последствий повреждений, как комплексные региональные болевые синдромы.
При переломе происходит разрыв кровеносньк сосудов кости и надкостницы. Спонтанно высвобождаемые биохимические агенты (факторы) учасгауют в индукции процессов заживления. При свежих переломах эти агенты весьма эффективны, и какой-либо дополнительной стимуляции практически не требуется.
Роль хирургического вмешательства — направить и поддержать процесс заживления.
Перелом и кровоснабжение кости
Хотя перелом -исключительно механический процесс, он вызывает важные биологические реакции, такие как резорбция кости и образование костной мозоли. Эти реакции зависят от сохранности кровоснабжения. Следующие факторы оказывают влияние на кровоснабжение в зоне перелома и имеют непосредственное значение для хирургического лечения:
- Механизм повреждения. Величина, направление и концентрация сил в зоне повреждения определяют тип перелома и сопутствующие повреждения мягких тканей. В результате смещения фрагментов разрываются периостальные и эндостальные сосуды, отделяется надкосгница. Кавитация и имплозия (внутренний взрыв) в зоне перелома вызывают дополнительные повреждения мягких тканей.
- Первичное лечение пациента. Если спасательные мероприятия и транспортировка происходят без шинирования переломов, смещения отломков в зоне перелома будут усугублять иоюдные повреждения
- Реанимация пациента. Гиповолемия и гипоксия увеличивают тяжесть повреждения мягких тканей и кости, поэтому должны быть устранены на ранних этапах лечения.
- Хирургический доступ. Хирургическое обнажение перелома неизбежно ведет к дополнительному повреждению, которое может быть минимизировано за счет точного знания анатомии, тщательного предоперационного планирования и скрупулезной хирургической техники
- Имплантат. Значительное нарушение костного кровотока может возникать не только из-за хирургической травмы, но и вследслвие контакта импдантата с костью.
Пластины с плоской поверхностью (напр. DCP) имеют большую площадь контакта. Динамическая компрессионная пластина с ограниченным контактом (LC-DCP) имеет вырезки на поверхности, обращенной к кости; она была разработана именно для уменьшения площади контакта. Однако площадь контакта зависит также от соотношения радиусов кривизны пластины и кости.
Если радиус кривизны нижней поверхности пластины больше, чем радиус кривизны кости, то их контакт может бьть представлен единичной линией, и это уменьшает преимущества LC-DCP по равнению с плоской поверхносгыо DCP. Наоборот, когда радикс кривизны пластины меньше радиуса кривизны кости, имеется контакт по обоим краям пластины (две линии контакта), и латеральные вырезки на LC-DCP в значительной сгепени уменьшат площадь контакта. - Последствия травмы. Повышенное внутрисуставное давление уменьшает циркуляцию крови в эпифизе, особенно у молодых пациентов. Доказано, что повышение гидравлического давления (за счет интракапсулярной гематомы) снижает кровоснабжение эпифиза при открытой зоне роста.
Мертвая кость может быть восстановлена только путем удаления и замещения (т.н. «ползущее замещение» за счет остеональной или пластинчатой перестройки), процесса, который требует для завершения продолжительного времени.
Общепризнано, что омертвевшая ткань (особенно кость) предрасположена к инфицированию и поддерживает его.
Еще один эффект некроза — индукция внутренней (гаверсовой) перестройки кости. Она делает возможной замену мертвых осгеоцитов, но прмводит к временному ослаблению кости из-за транзиторного осгеопороза, который является неотъемлемой частью процесса ремоделирования.
Остеопороз часто наблюдается непосредственно под поверхностью пластин и может быть уменьшен за счет сокращения площади контакта пластины с костью (напр. LC-DCP), что максимально сохраняет периосгальное кровоснабжение и уменьшает объем аваскулярной кости.
Немедленное снижение костного кровотока наблюдалось после перелома и остеотомии, при этом кровоснабжение кортикального слоя поврежденной части кости снижалось почти на 50%. Это снижение связывалось с физиологической вазоконсгрикцией как периосгальных, так и медуллярных сосудов, возникающей как ответная реакция на травму.
В процессе сращения перелома, однако, наблюдается увеличивающаяся гиперемия в прилежащих внутри- и внекостных сосудах, достигающая пика спустя 2 недели. После этого кровоток в области костной мозоли постепенно вновь снижается. Отмечается также временное изменение нормального центросгремительного направления кровотока на противоположное после повреждения медуллярной системы кровообращения.
Перфузия костной мозоли крайне важна и может определить результат процесса консолидации. Кость может формироваться только при поддержке сосудистой сети, и хрящ не будет жизнеспособен при отсутствии достаточной перфузии. Однако эта аншогенная реакция зависит как от метода лечения перелома, так и от созданньк механических условий.
- Сосудистая реакция более выражена при использовании более эластичной фиксации, возможно, вследсгвие большего объема костной мозоли.
- Значительное механическое напряжение ткани, вызываемое нестабильностью, уменьшает кровоснабжение, особенно в щели перелома.
- Хирургическое вмешательство при внутренней фиксации переломов сопровождается изменениями гематомы и кровоснабжения мягких тканей. После чрезмерного рассверливания костномозгового канала
- Эндостальный кровоток уменьшается, однако если рассверливание было умеренным, отмечается быстрая гиперемическая реакция.
- Рассверливание при интрамедуллярном осгеосинтезе приводит к замедлению восстановления кортикальной перфузии в зависимости от степени рассверливания.
- Рассверливание не оказывает влияния на кровоток в косгной мозоли, так как кровоснабжение мозоли зависит в основном от окружающих мягких тканей. В дополнение к широкому обнажению кости значительная площадь контакта кости и имплантата приведет к снижению костного кровотока, так как кость получает снабжение из периостальных и эндостальньпс сосудов.
- Нарушение кровоснабжения минимизируется путем отказа от непостредственной манипуляции фрагментами, применением минимально-инвазивных вмешательств, использованием внешних или внутренних фиксаторов.
Как срастается перелом
Различают два типа сращения перелома:
- первичное, или прямое, сращение путем внутренней перестройки;
- вторичное, или непрямое, сращение путем формирования костной мозоли.
Первый происходит только в условиях абсолютной стабильности и является биологическим процессом остеональной перестройки кости.
Второй наблюдается при относительной стабильности (эластичной фиксации). Происходящие при этом типе сращения процессы сходны с процессами эмбрионального развития кости и включают как интрамембранозное, так и эндохондральное формирование кости.
При диафизарньк переломах формируется костная мозоль.
Сращение кости можно разделить на четыре стадии:
- воспаление;
- формирование мягкой мозоли;
- формирование жесткой мозоли;
- ремодедирование (перестройка).
Хотя эти стадии имеют различные характеристики, переход от одной к другой происходит плавно. Стадии определены произвольно и описываются с некоторыми вариациями.
Воспаление
После возникновения перелома начинается воспалительная реакция, которая продолжается до начала формирования фиброзной, хрящевой или костной таани (1-7-е сутки после перелома). Первоначально образуются гематома и воспалительный экссудат из поврежденньк кровеносньк сосудов. У концов сломанной кости наблюдается остеонекроз.
Повреждение мягких тканей и дегрануляция тромбоцитов приводят к выбросу мощных цитокинов, которые вызывают типичную воспалительную реакцию, т.е. вазодилятацию и гиперемию, миграцию и пролиферацию полиморфноядерных нейтрофилов, макрофагов и т.д. Внутри гематомы образуется сеть фибриновых и ретикулярных волокон, также представлены коллагеновые волокна. Происходит постепенное замещение гематомы грануляционной тканью. Остеокласты в этой среде удаляют некротизированную кость на концах отломков фрагментов.
Формирование мягкой мозоли
Со временем боль и отек уменьшаются, и образуется мягкая мозоль. Это примерно соответствует времени, когда фрагменты уже не смещаются свободно, то есть приблизительно через 2-3 недели после перелома.
Стадия мягкой мозоли характеризуется созреванием мозоли. Клетки-предшественники в камбиальных слоях надкостницы и эндоста стимулируются для развития в остеобласты. Вдали от щели перелома на поверхности периоста и эндоста начинается интрамембранозный аппозиционный рост кости, за счет которого формируется периостальная муфта грубоволокнистой костной ткани и заполняется костномозговой канал. Далее происходят врастание в мозоль капилляров и повышение васкуляризации. Ближе к щели перелома мезенхимальные клетки-предшественники размножаются и мигрируют через мозоль, дифференцируясь в фибробласты или хондроциты, каждые из которых продуцируют характерный внеклеточный матрикс и медленно замещают гематому.
Формирование жесткой мозоли
Когда концы перелома связаны между собой мягкой мозолью, начинается стадия жесткой мозоли которая продолжается до тех пор, пока отломки не зафиксируются прочно новой костью (3-4 месяца). По мере прогрессирования внугримембранозного образования кости мягкая ткань в щели перелома подвергается энхондральной оссификации и трансформируется в жесткую кальцифицированную ткань (грубоволокнистую кость). Рост костной мозоли начинается на периферии зоны перелома, где деформации минимальны.
Формирование этой кости уменьшает деформации в расположенных ближе к центру отделах, где в свою очередь также формируется костная мозоль. Таким образом, формирование жесткой мозоли начинается по периферии и прогрессивно смещается к центру перелома и межотломковой щели. Первичный костный мостик формируется снаружи или внутри костномозгового канала, вдали от подлинного кортикального слоя. Затем, путем энхондральной оссификации, мягкая ткань в щели перелома замещается грубоволокнистой костью, которая в итоге соединяет первоначальные кортикальные слои.
Ремоделирование
Стадия ремоделирования начинается после прочной фиксации перелома грубоволокнисгой костной тканью. Она постепенно замещается пластинчатой костью путем поверхностной эрозии и остеональной перестройки. Этот процесс может занять от нескольких месяцев до нескольких лет. Он продолжается до тех пор, пока кость полностью не восстановит свою первоначальную морфологию, в том числе костномозговой канал.
Различия в сращении кортикальной и спонгиозной кости
В отличие от вторичного сращения кортикальной кости сращение спонгиозной кости происходит без формирования значимой внешней мозоли.
Посде стадии воспаления формирование кости осуществляется за счет интрамембранозной оссификации, что можно объяснить огромным ангиогенным потенциалом трабекулярной косги, а также используемой при метафизарных переломах фиксацией, которая обычно более стабильна.
В редких случаях значительной межфрагментарной подвижности щель перелома может заполняться промежуточными мягкими тканями, однако обычно это фиброзная ткань, которая вскоре замещается костной.

Перелом шейки бедра
Перелом шейки бедра — тяжелая и опасная травма, которая может возникать как у пожилых, так и у молодых людей….
Подробнее…
doclvs.ru
Внимание! информация на сайте не является медицинским диагнозом, или руководством к действию и предназначена только для ознакомления.
Источник
Данная монография о проблемах остеопороза вышла в свет в 2009 году. Пензенский профессор Виллорий Струков более полувека исследовал больных остеопорозом и изложил в работе свои взгляды на поистине мировую проблему потери человеком костной массы, перечислил методы лечения остеопороза, известные миру препараты. Эта работа была написана до того, как компания «Парафарм» выпустила препарат «Остеомед», который совместно разработали ученые — профессор В.И. Струков и физиолог В.Н. Трифонов.
Виллорий Иванович — постоянный участник и лектор всемирных конгрессов по костным заболеваниям. В своей врачебной практике он использовал различные способы лечения остеопороза и переломов, в том числе импортными препаратами — к примеру, американским «Цитракалом». Тем не менее, сегодня профессор Струков говорит о том, что «Остеомед» превзошел его ожидания, так как при его приеме скорость восстановления костной ткани гораздо выше импортных препаратов. А чем быстрее реабилитация человека, тем выше вероятность предотвратить повторный перелом.
С 2009 года Виллорий Иванович начал применять в своей врачебной практике «Остеомед». Результат — на сегодняшний день более чем у 10 тысяч его пациентов не наблюдались повторные переломы. Надо заметить, что такой заслуги нет ни у одного иностранного лекарственного препарата, предназначенного для лечения остеопороза.
«Актуальные проблемы остеопороза».
Монография
под редакцией
профессора, доктора медицинских наук,
зав. кафедрой педиатрии ГОУ ДПО
Пензенского института усовершенствования врачей
В.И. Струкова.
Авторский состав:
В. И. Струков,
М. Ю. Сергеева-Кондраченко,
О. В. Струкова-Джоунс,
Р. Т. Галеева, Л. Г. Радченко,
М. Н. Гербель, Е. Б. Шурыгина,
Л. Д. Романовская, Н. В. Еремина,
Н. А. Вирясова.
Рецензенты:
Л. М. Житникова, д.м.н., профессор кафедры семейной медицины
ММА им. И.М. Сеченова,
исполнительный директор Общероссийской Ассоциации
врачей общей практики.
В. А.Кельцев, д.м.н., профессор,
заведующий кафедрой факультетской педиатрии
ГОУ ВПО Самарского медицинского университета.
Типография «Ростра», 2009. с.342
Костная ткань представляет собой динамическую метаболически активную систему с сопряженными процессами резорбции и новообразования. В течение жизни костная ткань постоянно подвергается моделированию (росту, образованию вновь) в детском возрасте и ремоделированию (перестройке) во взрослом состоянии. Процесс обновления кости рассматривается в настоящее время с позиции теории интермедиарной организации скелета, ключевым понятием которой является «базисная мультиклеточная единица» — БМЕ — участок костной ткани, в котором при сотрудничестве различных типов клеток происходит сопряженный процесс роста и разрушения кости. В организме насчитывается примерно 10 млн таких единиц, состоящих из остеокластов, остеобластов, остеоцитов, макрофагов и моноцитов — предшественников остеокластов, клеток стромы — предшественников остеобластов Дамбахер М. А., Шахт Е., Франке Ю., Рунге Г. 2005 г.).
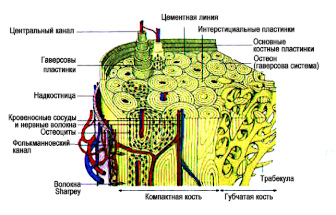
Скелет человека состоит на 20-25% из трабекулярной кости и на 75-80% из кортикальной (Рис.1). Кортикальная кость формирует диафизы трубчатых костей, имеет плотное строение, выполняет функцию опоры для мышечной ткани и служит для передачи мышечного сокращения. Трабекулярная кость состоит из костных пластинок толщиной 100-150 микрон, она формирует костные эпифизы и аксиальный скелет, ее основная функция состоит в обеспечении нормальной жизнедеятельности костного мозга и костной ткани.

Рис.1. Схема строения длиной кости на продольном и поперечном срезе
Ежегодно 10-25% скелета взрослого человека подвергается ремоделированию, причем в трабекулярной кости процессы метаболизма происходят быстрее. Костный кругооборот происходит в базисных мультиклеточных единицах — БМЕ (Рис .2, 3) и протекает стадийно: активация — резорбция — переходный период — образование костной ткани — минерализация (Parfit A. M., Chir M. D., Rasmussen H. еt al., Коровина Н. А., Захарова И. Н., Марченкова Л. А; Рожинская Л. Я.).
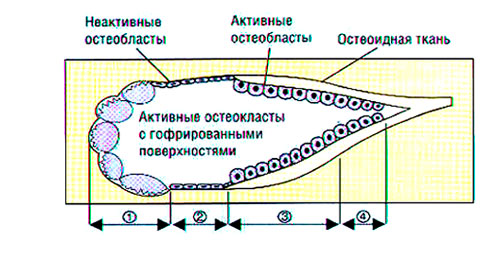
Рис. 2. Схема строения костной единицы ремоделирования (базисная мультиклеточная единица): 1.Остеобластная резорбция. 2.Фаза реверсии. 3.Формирования кости. 4. Минерализация остеоидной ткани
В фазу активации происходит пролиферация предшественников остеокластов в гемопоэтической ткани. Зрелые активированные остеокласты прикрепляются к поверхности резорбируемых участков и в течение 1-3 недель подвергают расплавлению неорганический матрикс, после чего органические элементы деградируют и фагоцитируются. Процесс резорбции происходит с обязательным поступлением в рассасываемый участок ионов водорода, углекислого газа и лизосомальных ферментов остеокластов. Углекислый газ, превращаясь в угольную кислоту, создает локальный ацидоз, способствующий разрушению солей кальция. В переходной фазе происходит созревание предшественников остеобластов, которые спустя 4-6 недель после начала резорбции откладывают в образованные полости костный матрикс со скоростью 2-3 мкм/день.
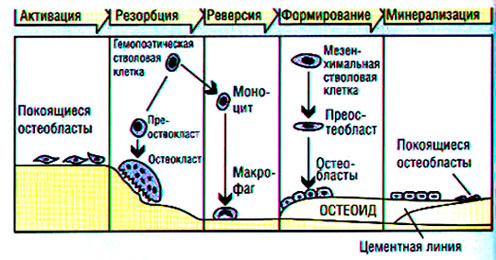
Рис.3. Цикл ремоделирования кости по Raisz L. G. (1988)
Главным составляющим органического матрикса является синтезируемый остеобластами фибриллярный белок коллаген, в значительной степени определяющий эластичность кости. В небольших количествах в органическом костном матриксе содержатся неколлагеновые белки — гликопротеины, сиалопротеины, альбумины, а также мукополисахариды, гликоген, органические кислоты, липиды.
После заполнения костных дефектов остеобласты превращаются в покоящиеся остеоциты, лежащие в костных лакунах, и формируют выстилающий слой, отделяющий костную поверхность от сосудов. В количественном отношении остеоциты преобладают, эти клетки принимают активное участие в постоянном обмене минеральных и органических компонентов между костным матриксом и тканевой жидкостью, фильтруемой из сосудов (Parfitt A. M.).
Образованный остеобластами коллаген подвергается минерализации, при этом часть кости формируют кристаллы гидроксиапатита, а другая представлена аморфным фосфатом кальция (АФК). Образовавшийся АФК становится источником ионов кальция и фосфора, поскольку аморфный кальций более растворим, чем гидроксиапатит. Механизм превращения АФК в гидроксиапатит является до конца не изученным. Возможно, при этом происходит растворение и гидратация ионов твердой поверхности АФК, передвижение образовавшихся гидратированных ионов и последующий рост кристаллов гидроксиаппатита (Parfitt A. M.).
Всего на долю кальция фосфата приходится в аморфной и кристаллической формах до 85% минеральной массы кости, кальция карбоната 10%, кальция фторида 0.3%, кальция хлорида 0.2%, магния фосфата — 1%, щелочных солей — 2%. Кроме того, в костной ткани присутствуют в незначительных количествах ионы цинка, кремния, алюминия, бария: бериллия, меди и других микроэлементов. Процесс минерализации костного матрикса занимает 5-10 дней. Полностью костеобразование длится около трех месяцев, а полный цикл обновления в каждом участке занимает 4-8 месяцев. (Huffer W. F., цитир. В. И. Струков, 2004 г.).
В основе остеопоротических изменений в костях важная роль принадлежит нарушениям в гормональной регуляции ремоделирования. В результате воздействия эндогенных и экзогенных факторов риска остеопороза происходят сложные нарушения в регулировании метаболизма костной ткани. Особенно значительные нарушения происходят в следующих гормонах:
- паратгормон (стимулятор резорбции);
- тироксин (стимулятор резорбции);
- эстрогены (ингибиторы резорбции);
- кальцитонин (ингибитор резорбции);
- гормон D (минерализация костей);
- медиаторы (цитокины, факторы роста).
Все эти соединения имеют огромное значение в метаболизме кальция. Са – особый минерал. В отличие от сотен тысяч органических соединений, которые организм может производить сам, источником минералов является внешняя среда. Все минералы важны для нормальной работы организма, однако кальций занимает среди них особое место. Его содержание в организме превышает содержание всех остальных минералов и составляет около 2% массы тела. Са участвует более чем в 300 жизненно важных реакциях организма. Соли кальция обеспечивают прочность костей. Без кальция невозможна работа сердца и сосудов, сокращение мышц, деятельность головного мозга и нервной системы и т.д. 99% кальция находится в костях, обеспечивая их прочность, и лишь 1% — в крови, клетках и других биологических жидкостях. Нарушения в кальциевом обмене являются одной из важной причиной нарушения ремоделирования костной ткани, что ведет к резкой активации остеокластов и преобладанию процессов разрушения кости над ее созиданием. Это обстоятельство ведет в конечном счете к изменению морфологии и качества кости, что является причиной её переломов, нередко от небольшой травмы.
Основные патофизиологические механизмы переломов костей при остеопорозе представлены на рис. 4.
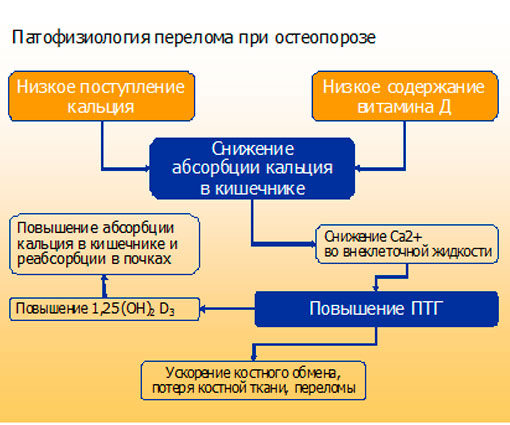
Рис.4. Патофизиологические механизмы развития переломов
Как видно, решающее значение в развитии остеопороза и переломов имеют низкое поступление кальция с пищей, гиповитаминоз D. Это обуславливает снижение абсорбции кальция в кишечнике, развитие гипокальциемии и, как следствие, повышенной продукции паратгормона (ПТГ). Последний обуславливает потерю костной ткани и их переломы.
- Актуальные проблемы остеопороза. Монография
- Актуальные проблемы остеопороза. Список сокращений
- Актуальные проблемы остеопороза. Монография В.И. Струкова. Введение
- Актуальные проблемы остеопороза. Часть I. Физиология костной ткани и патфизиология костных переломов. В. И. Струков
- Актуальные проблемы остеопороза. Часть II. Факторы риска остеопороза. В.И. Струков
- Актуальные проблемы остеопороза. Часть II. Факторы риска остеопороза. В.И. Струков
- Актуальные проблемы остеопороза. Часть III. Классификация остеопороза. Клинические варианты остеопороза, определение. В.И. Струков
- Актуальные проблемы остеопороза. Часть IV. Вторичный остеопороз
- Актуальные проблемы остеопороза. Часть V. Диагностика остеопороза
- Актуальные проблемы остеопороза. Часть VI. Остеопения и остеопороз у детей и подростков
- Актуальные проблемы остеопороза. Часть VII. Профилактика и лечение остеопороза
- Актуальные проблемы остеопороза. Заключение
Источник
